Gastrites e úlceras
Introdução
Estima-se que 50,8% da população de países em desenvolvimento sejam acometidos por gastrite (Evelyn P T, 2018)(Marcis, 2018). No Brasil, as gastrites crônicas podem acometer cerca de 67,8% das mulheres e 32,2% dos homens (Colpo E, 2012).
Este texto tem como objetivo reunir informações que ajudem a entender um pouco mais sobre essa importante doença.
O que é a gastrite afinal?
Como todos devem imaginar, gastrite significa inflamação do estômago, ou mais especificamente, de seu revestimento interno, a mucosa(Varella, 2019).E se manifesta através de sintomas como náuseas, vômitos, dor epigástrica, desconforto do abdome superior, sensação de plenitude e perda do apetite, entre as principais queixas registradas.
A gastrite pode ser classificada, temporalmente, em aguda ou crônica, considerando-se o tempo de evolução. Define-se, por convenção, que a partir de 30 dias, a gastrite deixa de ser chamada aguda para ser considerada crônica(Miranda A, 2019)(Sierra K, 2014). É claro que se formos refinar, verificaremos que há diferenças histológicas entre uma e outra. As gastrites chamadas agudas apresentam uma infiltração por neutrófilos, predominantemente, enquanto as gastrites chamadas crônicas, apresentam uma mistura de células mononucleares, predominantemente linfócitos, mas também plasmócitos e macrófagos, que denotam um processo inflamatório de maior duração.
Existem divergências e muitas controvérsias no uso da palavra gastrite, propriamente, que exige a comprovação histológica (através de biópsia) da presença de atividade inflamatória na mucosa gástrica, pois há alterações macroscopicamente visíveis sobre a mucosa gástrica que à luz da microscopia, não demonstram essa característica. Dessa forma, cunhou-se a definição de gastropatia para as alterações de mucosa gástrica em que injúria da mucosa e processo regenerativo sem evidência ou apenas mínima alteração sugestiva de inflamação.
Gastropatia e gastrite: e daí?
É interessante a distinção de gastropatia e gastrite, pois muitas vezes, apesar do endoscopistaencontrar alterações visuais na mucosa gástrica e nomeá-la de gastrite endoscópica, há uma baixa correlação quando se realiza uma biópsia dessa mucosa, ou seja, o coeficiente de concordância kappa é de cerca de 0,212(Luiz Carlos Berteges, 2018). Quanto mais esse coeficiente se aproxima de 1, maior a concordância.
Isso quer dizer que o endoscopista registra como gastrite endoscópica, tecnicamente pode se tratar de uma gastropatia. Existe alteração da mucosa, mas não há inflamação. Isso é importante, pois há diferentes causa para gastrite e gastropatia.Vejamos o quadro a seguir:
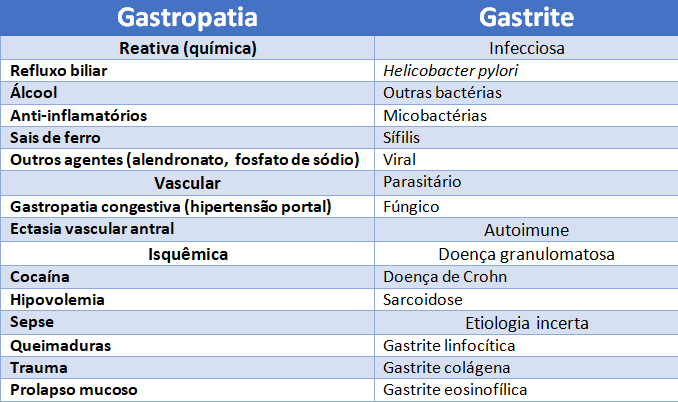
Classificação das gastrites endoscópicas
Apesar da baixa correlação, ainda assim é preciso registrar e relatar as alterações de mucosa que são identificadas pelo endoscopista. Se é gastrite de fato, ou não, só a biópsia dirá. A classificação mais utilizada atualmente é a classificação de Sidney, ainda que não contemple todas as alterações e não tenha valor prognóstico. Essa classificação leva em consideração a topografia, a característica visual e a intensidade das alterações registradas
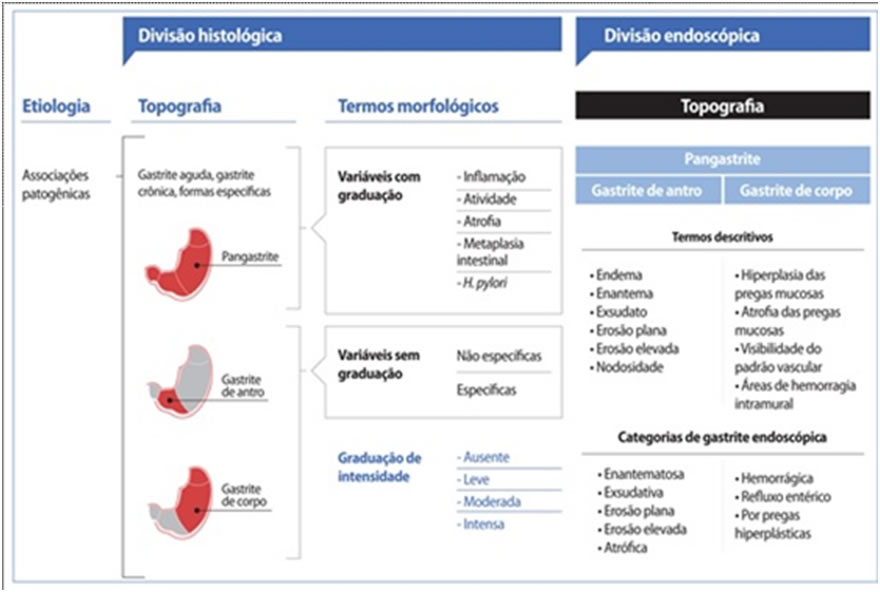
(Milena R Macitelli, 2014)
É interessante observar que não há correlação direta entre os achados endoscópicos e os sintomas referidos (Maria Aparecida A O Serra, 2021), da mesma forma que não há uma correlação direta com os achados histopatológicos. Desta forma, é importante a análise de cada caso à luz das manifestações clínicas apresentadas por cada indivíduo, com a compreensão de que a sintomatologia é multifatorial.
Como a gastropatia e as gastrites podem determinar os sintomas dispépticos?
O trato digestório é forrado por receptores que detectam as diferentes alterações que se passam com sua estrutura. Há vários nociceptores, que percebem a ação de diferentes substâncias químicas, temperatura, pressão, entre outros, transmitindo essas informações ao sistema nervoso intestinal e ao sistema nervoso central, produzindo diferentes respostas, como a percepção de dor, estufamento, náuseas, ou mesmo determinar vômitos.
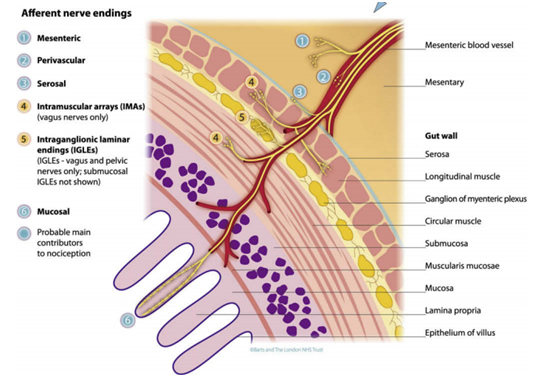
As lesões produzidas pelos diferentes agentes agressores, causando respostas inflamatórias, podem ainda ativar receptores chamados de silentes, ou silenciosos, que aumentam ainda mais a percepção das agressões ao trato digestório, reduzindo o limiar de disparo dos nociceptores e determinando hiperalgesia secundária ou sensibilização central. Ou seja, uma vez ativos, até mesmo estímulos que normalmente não produzem incômodo ao trato digestório passam a ser amplificados e desencadear respostas inesperadas, como dor, sensação de distensão.
Diferentes neurotransmissores e enteropeptídeos estão envolvidos no transporte dos sinais, no processo de transdução e resposta local ou sistêmica. Os mais conhecidos são a acetilcolina, a serotonina, a dopamina, a colecistoquinina e a motilina, entre outras. Diferentes espectros e manifestações são descritas com o envolvimento de cada uma dessas substâncias e a intervenção clínica também tem respostas variáveis em função das manifestações, envolvendo, muitas vezes, intervenções multimodais para que se obtenha alívio dos sintomas.
E agora que o endoscopista disse que há uma gastrite, o que fazer?
Se a endoscopia foi realizada, deve ser porque havia sintomas que indicavam sua necessidade. Independentemente se é uma gastropatia ou uma gastrite, há uma lesão da mucosa gástrica e algumas medidas devem ser adotadas a fim de melhorar os sintomas:
- Adotar comportamentos que ajudam o estômago a funcionar melhor:
- Respeite os horários das refeições
- Coma devagar
- Coma pequenas porções ao longo do dia ao invés de fazer grandes refeições após longos períodos de jejum
- Mastigue bem os alimentos
- Dê preferência a frutas menos ácidas, a verduras e a carnes magras
- Evite ingerir líquidos durante as refeições (deixe para tomar antes ou após as refeições)
- Desligue a televisão e guarde o celular durante as refeições
- Controle a ansiedade e o estresse
- Cessar o fumo (todos os tipos de cigarro, inclusive os eletrônicos)
- Evitar alimentos que podem danificar a mucosa gástrica:
- Produtos com cafeína – café, chá preto, chá matte
- Chocolate
- Refrigerantes
- Sal em excesso
- Enlatados
- Embutidos
- Bebidas alcoólicas
- Pimentas
- Leite e derivados
- Frituras
- Gorduras em excesso
- Frutas ácidas
O uso de medicamentos que reduzem a acidez gástrica, aliados às mudanças comportamentais e alimentares, podem ajudar no processo de restabelecimento da mucosa gástrica e melhorar os sintomas, tanto na gastropatia, como na gastrite. Geralmente o tratamento inicial deve considerar a intensidade dos sintomas e ser mantido por um período mínimo de 30 a 60 dias.
E esse tal de H. pylori?
Na maior parte das vezes quando há gastrite de fato e não uma gastropatia, o Helicobacter pilory está envolvido, como já vimos antes. Desta forma, muitas vezes, apesar de não se realizar uma biópsia formal, que exige a obtenção de uma amostra da mucosa gástrica, preparação do material e leitura da lâmina, pode-se fazer a pesquisa de Helicobacter pylori através do teste de urease. Esse teste mostra a presença dessa enzima, a urease, produzida pelo Helicobacter pylori, e que permite a elevação do pH local por transformação da ureia em amônia e bicarbonato, criando um ambiente propício para sua sobrevivência. O teste positivo é indicativo da presença de urease, sugerindo a presença do Helicobacter pylori (90% de sensibilidade e 95% de especificidade), mas também há a possibilidade de infecções por Staphylococcusepidermidis, Proteusspp e Klebsiellapneumoniae, entre outros.
A presença de Helicobacter pylori pode levar ao desenvolvimento de câncer gástrico por atuação direta sobre a mucosa, ou através do desenvolvimento de gastrite crônica que culmina com gastrite atrófica, que é uma condição predisponente ao câncer, como está esquematizado a seguir.
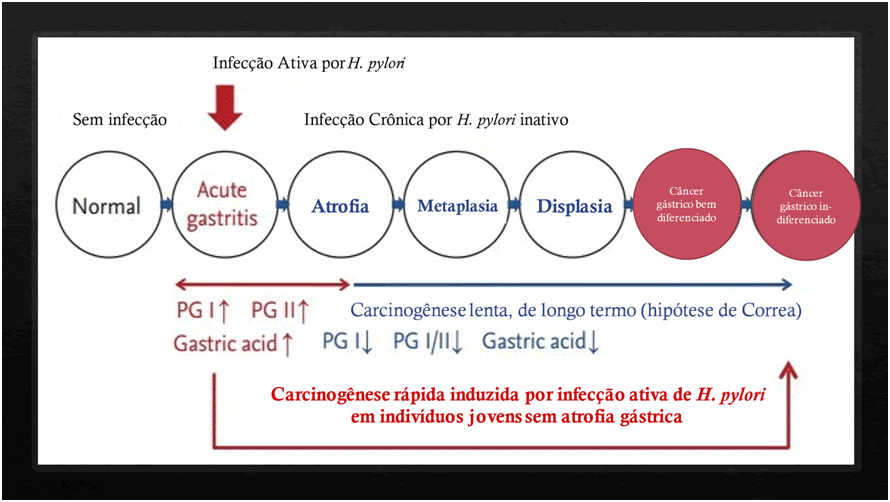
Uma vez que se detecte o Helicobacter pylori, seu tratamento deve ser considerado. Desta forma, também é importante que a testagem só seja realizada quando há intuito terapêutico. As indicações formais são:
- Linfoma de mucosa gástrica – Linfoma MALT
- Úlcera péptica ativa ou histórico recente de úlcera gástrica
- Câncer gástrico precoce ou inicial
Outras indicações de pesquisa do H. pylori são mais controversas, como:
- Dispepsia em pacientes com menos de 60 anos, sem sinais de alarme
- Antes de dar início de a tratamento com anti-inflamatórios não esteroidais, como o AAS
- Nas deficiências de ferro inexplicadas
- Na trombocitopenia de origem imunológica
- Em pacientes com histórico familiar de câncer gástrico
- Portadores de gastrite linfocítica, pólipos gástricos hiperplásicos
- E talvez na hiperemese gravídica.
Sobre o H. pylori, propriamente, seria necessário um capítulo a parte. Colonizações persistentes de hospedeiros por micróbios são raramente acidentais. Estudos de dados genômicos mostram que a relação com o H. Pylori tem pelo menos 58.000 anos(Dae Young Cheung, 2012). Tradicionalmente, relacionamentos nocivos terminam com a morte do hospedeiro ou a eliminação do invasor. Persistência exige coexistência, que deve ser governada por um relacionamento equilibrado, que se divide em: parasitismo, comensalismo e simbiose. No caso do Helicobacter pylori, no entanto, essas definições não sejam as mais adequadas, cabendo a possível definição de “anfibiótico”, que pode ou não determinar doença, dependendo de determinadas condições(Blaser, 1997)(Vasiliy Ivanovich Reshetnyak, 2021). Há muita discussão para ocorrer ainda. No momento, a regra é tratar quando há alterações da mucosa e sua presença é definida.
Qual o problema de se ter uma gastrite?
Além dos sintomas dispépticos, pacientes sem tratamento para a causa da gastrite podem evoluir com a sua cronificação (gastrite crônica) e desenvolver problemas como:
- Anemia – gastrites e úlceras gástricas podem sangrar, produzindo anemia;
- Anemia perniciosa – a gastrite crônica, pode afetar a produção de uma substância chamada Fator Intrínseco pelas células neuroendócrinas do estômago, reduzindo a capacidade do organismo absorver vitamina B12;
- Úlceras gástricas – gastrites podem evoluiu para a formação de úlceras gástricas, que podem sangrar, perfurar ou mesmo evoluir para o câncer gástrico;
- Câncer gástrico – a gastrite crônica, como todo processo inflamatório crônico, pode permitir o surgimento de um ambiente propício para o desenvolvimento de câncer.
Gastrites crônicas
As gastrites agudas, sem tratamento adequado podem evoluir para gastrites crônicas, que pode ser:
- Atróficas sem metaplasia intestinal ou
- Atrófica com metaplasia intestinal
As gastrites atróficas têm etiologia infecciosa ou autoimune, essencialmente, sendo caracterizada pela presença de adelgaçamento da mucosa gástrica associada a inflamação crônica, com a perda de células especializadas da glândula gástrica, além de modificações no tipo de célula epitelial de sua mucosa. Duas formas são descritas:
1) AMAG – Gastrite Atrófica Metaplásica Autoimune
a. resulta na substituição das células oxínticas normais da mucosa do corpo gástrico por uma mucosa atrófica e metaplásica, com redução da produção de ácido clorídrico, pepsina e fator intrínseco.
b. Ocorre em 2% dos casos, associado a doenças da tireoide e diabetes tipo 1 em mais de 30% dos casos, resultando da formação de autoanticorpos contra as H/K ATPases das células parietais e o Fator Intrínseco.
c. Possui associação com alterações dos genes Gasa 1,2,3 e 4, dos cromossomos 4 e 6, e com o gene do complexo H2 em murinos. Alguns desses genes estão localizados no mesmo locusdo gene de suscetibilidade ao Diabetes.
d. Há evidências de associação da AMAG com infecção por H. pylori na infância. Mas há baixa detecção dessa bactéria no estômago na vida adulta, possivelmente porque o ambiente se tornou hostil pelo pH elevado e supercrescimento de outras bactérias.
e. Sua manifestação é de desconforto pós-prandial e da baixa absorção de vitamina B12 (fadiga, irritabilidade, alterações cognitivas, glossite e parestesias, por exemplo)
f. Laboratorialmente podemos observar hipergastrinemia sérica de jejum, Redução da razão pepsinogênio tipo I/II, deficiência de ferro e deficiência de vitamina B12.
g. Esse grupo de indivíduos apresenta risco aumentado para o desenvolvimento de tumores por células neuroendócrinas (carcinóides) e adenocarcinomas.
2) EMAG – Gastrite Atrófica MetaplásicaAmbiental (Environmental, em inglês)
a. Parece resultar da ação de fatores ambientais, como a infecção por H. pylori e fatores alimentares, como exposição a sal em excesso, cigarro, bebida alcoólica, refluxo biliar, consumo de embutidos.
b. Essa entidade aumenta o risco de desenvolvimento de câncer gástrico em 10 a 15 vezes, particularmente do tipo intestinal de Lauren.
O risco para o desenvolvimento de câncer gástrico pode ser melhor quantificado através da aplicação de tabelas como o OLGA (Operative Link for Gastritis Assessment) e OLGIM (Operative Link onGastric Intestinal Metaplasia Assessment).
Para um diagnóstico acurado, as biópsias devem ser realizadas forma a mapear a mucosa gástrica da forma mais completa possível, como está representado no esquema a seguir. E a presença de Helicobacter pylori deve ser pesquisada ativamente.
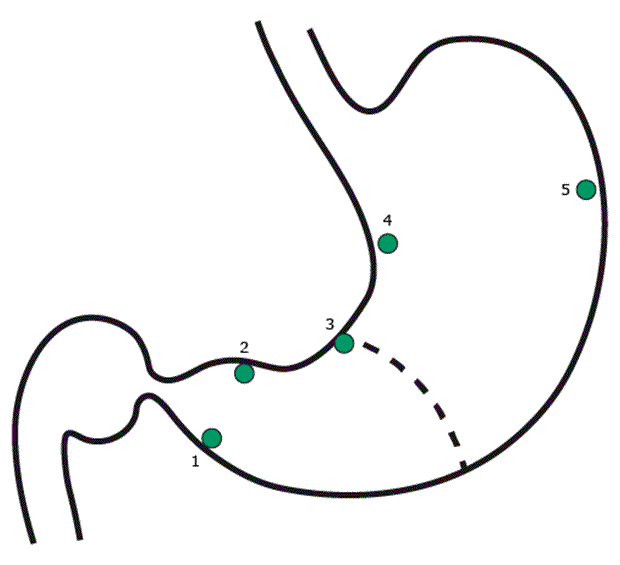
A metaplasia intestinal, que é caracterizada pela substituição da superfície foveolar e glandular da mucosa antral por epitélio intestinal, podendo ser dividida em três subtipos:
- Tipo I ou completa – há formação de epitélio intestinal, incluindo enterócitos absortivos eosinofílicos, com uma borda em escova definida, células de Paneth e células caliciformes contendo sialomucinas;
- Tipo II ou incompleta –lembra o epitélio cólico, sem borda em escova e grande quantidade de células caliciformes irregulares com gotículas de mucina (sialomucina) de diferentes tamanhos entremeadas a células do tipo gástrico.
- Tipo III ou incompleta –há células caliciformes entremeadas às células gástricas, lembrando um epitélio cólico, com predomínio de sulfomucinas ao invés de sialomucinas.
A intensidade das alterações, como já foi mencionada, pode ser avaliada pelas tabelas OLGA e OLGIM.
Como fazer o seguimento nos casos de gastrite crônica?
Nas gastrites agudas, recomenda-se o tratamento inicial, com a realização de endoscopia com pesquisa de urease nos casos em que há sinais de alarme ou falha terapêutica.
Nos casos de gastrite atrófica, com acometimento gástrico difuso, indica-se a realização de endoscopia a cada 2 ou 3 anos, conforme o histórico familiar de câncer gástrico. Em pacientes com gastrite atrófica restrita ao antro, entretanto, essa regra não se aplica por não haver evidências de maior risco de câncer gástrico nessa população(Pimentel-Nunes P, 2019). (ESGE, 2019)
E a úlcera gástrica? O que é?
A úlcera péptica, que pode ser gástrica ou duodenal, ou mesmo entérica, nos casos em que há anastomose intestinal com o estômago (como nas gastroplastias redutoras com by-pass), é uma lesão da mucosa que se estende através da muscular da mucosa para planos mais profundos da parede do órgão afetado.
É interessante que até 70% dos casos podem ser assintomáticos (Lu CL, 2004), outras vezes sua primeira manifestação é o sangramento digestivo alto (43 a 87%). Quando sintomáticos, porém, o sintoma mais frequente é dor abdominal, associados a alimentação quando gástrica e após 2 a 5 horas da alimentação, nas úlceras duodenais. Os sintomas mais frequentes, bem como as complicações mais frequentes estão listadas a seguir:
- Hemorragia digestiva alta
- Suboclusão alta
- Perfuração e fistulização
A perfuração ocorre em 2 a 10% doas casos. E o tratamento é cirúrgico. Nos demais casos, o tratamento passa por investigação por endoscopia, biópsias e teste de urease, assim como eliminação dos fatores de risco, como etilismo, tabagismo, uso de anti-inflamatórios não esteroidais, erradicação do Helicobacter pylori, alteração dos hábitos alimentares e controle da ansiedade.
Referências
Blaser, M. J. (1997). Ecology of Helicobacter pylori in the Human Stomach. The Jorunal of Clinical Investigation, 100(4): 759-62.
Colpo E, D. L. (2012). Factors Associated With Chronic Gastritis in Patientes with Presence and Absence of Helicobacter Pylori. ABCD Arq Bras Cir Dig, 25(2): 96-100.
Dae Young Cheung, T. H. (2012). Helicobacter pylori in Human Stomach: Can It Be Called Mutualism or a Disease? Korean J Gastroenterol, 59(9):329-37.
Evelyn P T, F. F. (2018). Epidemiological and Clinical-Pathological Aspects of Helicobacter pylori Infection in Brazilian Children and Adults. Gastroenterology Research & Practice, http://doi.org/10.1155/2018/8454125.
Lu CL, C. S. (2004). Silent peptic ulcer disease: frequency, factors leading to "silence", and implications regarding the pathogenesis of visceral symptoms. Gastrointest Endosc, 60(1): 34.
Luiz Carlos Berteges, F. N. (2018). ComparaçÃo entre os achados endoscópicos e o diagnóstico histológico de gastrite antral. Arq Gastroenterol, 55(3): 212-15.
Marcis, L. O. (2018). Epidemiology of Helicobacter Pylori Infection. Wiley Helicobacter, 23(1) e12514.http://doi:10.1111/hel.12514.
Maria Aparecida A O Serra, A. T. (2021). Correlation between the symtoms of upper gastrointestinal disease and endoscopy findings: Implications for clinical practice. Journal of Taibah University Medical Sciences, 16(3): 395-401.
Milena R Macitelli, U. F. (2014). Gastrites. Fonte: igastroped.com.br: https://www.igastroped.com.br/gastrites/
Miranda A, C. C. (2019). Gender, Age, Endoscopic Findings, Urease and Helicobacter Pylori: All Uncorrelated Within a Sample of Hfigh Gastric Cancer Prevalence Population in Amazon. Arq Gastroenterol, (6): 254-269.
Pimentel-Nunes P, L. D.-P.-B.-R. (2019). Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and SPED - 2019. Endoscopy, 51(4): 365.
Sierra K, S. G. (2014). What is Gastritis? What is GastropathY? How is it Classified? Turk J Gastroenterol, 25: 223-47.
Up-to-date . (agosto de 2021). Etiology-based classification of gastropathy and gastritis. Fonte: Up-to-date: https://www.uptodate.com/contents/ gastritis-etiology-and-diagnosis?search=gastrite&source=search_result&selectedTitle=1 ~150&usage_type=default&display_rank=1
Varella, D. (abril de 2019). Gastrite. Fonte: Biblioteca Virtual em Saúde - Ministério da Saúde: https://bvsms.saude.gov.br/gastrite/
Vasiliy Ivanovich Reshetnyak, A. I. (2021). Helicobacter pylori: Commensal, symbiont or pathogen? World Journal of Gastroenterology, 27(7): 545-60.
Mais artigos e textos
- Abdome agudo - colaboração da LAACPira
- Adenomas hepáticos
- Calculadora de atividade de colite ulcerativa
- Calculadora de atividade de doença de Crohn
- Calculadora de MELD
- Calculadora de risco cardíaco
- Calculadora de risco cirúrgico
- Câncer de intestino grosso (cólon e reto)
- Choosing Wisely Recommendations
- Cirurgia Bariátrica - orientações
- Cistos hepáticos - aula
- Colostomias - orientação de cuidados do INCA
- Critério de Milão para transplante hepático
- Cuidados pós-operatórios
- Diverticulite / Diverticulose / Doença Diverticular
- Doenças hepáticas - parceria com o hepcentro.com
- Dor anal
- Endometriose Intestinal
- Gastrites e úlceras
- Helicobacter pylori
- Hemorroidas
- Intolerância ao glúten
- Lesões císticas do pâncreas
- Oito atitudes que podem atrapalhar sua recuperação após uma cirurgia
- Orientações pré-operatórias
- Pâncreas: Tumores malignos
- Parceiros da GastroCentro Piracicaba
- Refluxo gastroesofágico
- Tumores hepáticos
- Vesícula biliar – cálculos e pólipos
Gastrocentro
Cirurgia do Aparelho Digestivo e Coloproctologia | Cirurgia de Obesidade e Cirurgia Oncológica
Médico Responsável Técnico: Dr. Juliano Borges Barra - CRM 97558
